Su mandato regionale l’Istituto Zooprofilattico Sperimentale delle Venezie (IZSVe) sta monitorando le caratteristiche genetiche e la variabilità dei ceppi di SARS-CoV-2 presenti in Veneto. Nelle ultime settimane è stata effettuata la sequenza del genoma completo di 8 ceppi SARS-CoV-2 identificati nelle province di Vicenza e Treviso tra il 2 e il 21 dicembre, per un totale di 53 campioni analizzati da novembre.
Questi 8 virus appartengono a cinque diversi lineage (o varianti), portando il numero totale di lineage circolanti in Veneto da novembre a dieci. Cinque degli otto casi analizzati riguardavano soggetti provenienti dal Regno Unito. L’analisi condotta ha dimostrato che questi campioni appartengono ai lineage B.1.1.7 (variante inglese VUI 202012/01), B.1.1.1 e B.1.177.7. I rimanenti tre campioni appartengono ai lineage B.1.258 e B.1.177. A livello nazionale il 4,6% e il 45% delle sequenze disponibili in GISAID in data 30/12/20 ottenute da campioni prelevati nel periodo Novembre-Dicembre appartengono rispettivamente ai lineage B.1.258 e B.1.177 (figure 1 e 2).
Si sottolinea che il numero di campioni sequenziati ad oggi dall’IZSVe è limitato rispetto al numero di casi positivi in Veneto e fornisce solo un’istantanea parziale delle possibili varianti circolanti nel territorio.
Si ringraziano tutti i laboratori della Regione che hanno fornito e continuano a fornire i campioni necessari allo studio dei SARS-CoV-2 circolanti in Veneto.
Descrizione delle varianti identificate
Analisi filogenetica (Pangolin lineage)
I virus circolanti in Veneto da novembre 2020 appartengono a dieci diversi Pangolin lineage (B.1.1.1, B.1.1.217, B.1.1.241, B.1.160, B.1.160.7, B.1.177, B.1.221, B.1.258, B.1.177.7, B.1.1.7). I lineage B.1.1.7 e B.1.177.7 non erano mai stati identificati in Veneto prima d’ora.
Nessuno dei 53 campioni analizzati finora appartiene al lineage B.1.351 (variante identificata in Sud Africa).
- Lineage B.1.1.1(N=2)
Si tratta di uno dei lineage più diffusi nel territorio Italiano, identificato in Veneto da marzo 2020.
Mutazioni da segnalare nella proteina Spike: D614G - Lineage B.1.1.217(N=1)
Non ancora descritto in Italia secondo i dati disponibili in GISAID in data 30/12/2020. Virus appartenenti a questo lineage sono stati identificati in precedenza in diversi paesi europei.
Mutazioni da segnalare nella proteina Spike: D614G - Lineage B.1.1.241(N=1)
Non ancora descritto in Italia secondo i dati disponibili in GISAID in data 30/12/2020. Virus appartenenti a questo lineage sono stati identificati in precedenza in diversi paesi europei.
Mutazioni da segnalare nella proteina Spike: A352S, D614G - Lineage B.1.160 e B.1.160.7 (N=16)
Identificato nel territorio italiano a partire da ottobre. Virus appartenenti a questo lineage sono stati identificati da marzo in diversi paesi europei, in particolare Regno Unito, Francia e Svizzera.
Mutazioni da segnalare nella proteina Spike: S477N, D614G - Lineage B.1.177 (N=23) e B.1.177.7 (N=1)
Identificato nel territorio italiano a partire da agosto. Virus appartenenti a questo lineage sono stati identificati da marzo in diversi paesi europei, in particolare Regno Unito, Spagna e Danimarca.
Mutazioni da segnalare nella proteina Spike: A222V, D614G
- Lineage B.1.221(N=3)
Identificato nel territorio italiano a partire da agosto. Virus appartenenti a questo lineage sono stati identificati in precedenza in diversi paesi europei.
Mutazioni da segnalare nella proteina Spike: D614G - Lineage B.1.258(N=3)
Identificato nel territorio italiano a partire da ottobre. Virus appartenenti a questo lineage sono stati identificati in precedenza in diversi paesi europei.
Mutazioni da segnalare nella proteina Spike: delezione 69-70 (in 1/3 virus), N439K, D614G - Lineage B.1.1.7 (N=3)
Lineage a cui appartengono i virus della variante VUI-202012/01 identificata nel Regno Unito a partire da settembre. Questo lineage è stato identificato per la prima volta nel territorio italiano a dicembre. Si tratta di una variante di particolare interesse in quanto sembra essere caratterizzata da una maggiore trasmissibilità. Tale variante si contraddistingue per 17 mutazioni (14 sostituzioni amminoacidiche e 3 delezioni) lungo il genoma.
Mutazioni caratterizzanti tale variante nella proteina Spike: delezione 69-70, delezione 144, N501Y, A570D, P681H, T716I, S982A, D1118H
Analisi delle mutazioni
I virus identificati appartenenti al lineage B.1.1.7 (“variante inglese” VUI-202012/01) presentano tutte le 17 mutazioni caratteristiche di tale variante, inclusa la mutazione N501Y nel sito di legame al recettore della proteina Spike e la delezione in posizione 69-70. È stata inoltre riscontrata la presenza della mutazione N439K nel sito di legame al recettore della proteina Spike nei due campioni appartenenti al lineage B.1.258. Tale mutazione è stata associata ad un aumento dell’affinità per il recettore umano ACE2 e alla capacità di eludere l’attività neutralizzante di alcuni anticorpi monoclonali e di anticorpi presenti nel siero di una parte di individui guariti dall’infezione (Thomson et al., non peer-reviewed). Ad oggi, la mutazione N439K non è stata associata ad un aumento della severità della malattia.
Elenco delle mutazioni rilevanti nella proteina Spike identificate nei campioni del Veneto da novembre
- D614G. Mutazione non presente nei primi campioni di SARS-CoV-2. Oggi è una mutazione diffusa ed è associata ad un aumento della trasmissibilità del virus.
- Delezione 69-70. Identificata in un singolo campione appartenente al lineage 1.258 e in tutti i campioni appartenenti al lineage B.1.1.7. Questa delezione potrebbe essere associata all’evasione della risposta immunitaria dell’ospite e potrebbe compromettere il risultato di alcuni test diagnostici che hanno come target il gene S.
- A222V. Identificata nei 24 campioni del lineage B.1.177, il quale mostra un notevole aumento di frequenza a livello nazionale e regionale. Tale lineage sembra essersi originato in Spagna, da dove si è diffuso nel resto dell’Europa. Tuttavia non ci sono chiare evidenze sull’effetto di questa mutazione. 7/24 campioni appartenenti al lineage B.1.177 presentano anche le mutazioni A262S e P272L.
- A352S. Mutazione nel dominio di legame al recettore. Identificata in un singolo campione appartenente al lineage B.1.241.
- N439K. Mutazione nel dominio di legame al recettore. Identificata in tre campioni appartenenti al lineage B.1.258. è associata ad un aumento dell’affinità per il recettore umano ACE2 ed è in grado di evadere l’attività neutralizzante di alcuni anticorpi monoclonali e di anticorpi presenti nel siero di una parte di individui guariti dall’infezione.
- S477N. Mutazione nel dominio di legame al recettore. Identificata in 16 campioni appartenenti al lineage B.1.160 e B.1.160.7. Questa mutazione sembra essere associata ad un aumento dell’affinità per il recettore umano ACE2 (Grid Based Pharmacophore Model) ed è in grado di evadere l’attività neutralizzante di alcuni anticorpi monoclonali.
- N501Y. Mutazione nel dominio di legame al recettore. Identificata in tutti i campioni appartenenti al lineage B.1.1.7. è associata ad un aumento dell’affinità per il recettore umano ACE2.
Figure (cliccare per ingrandirle)
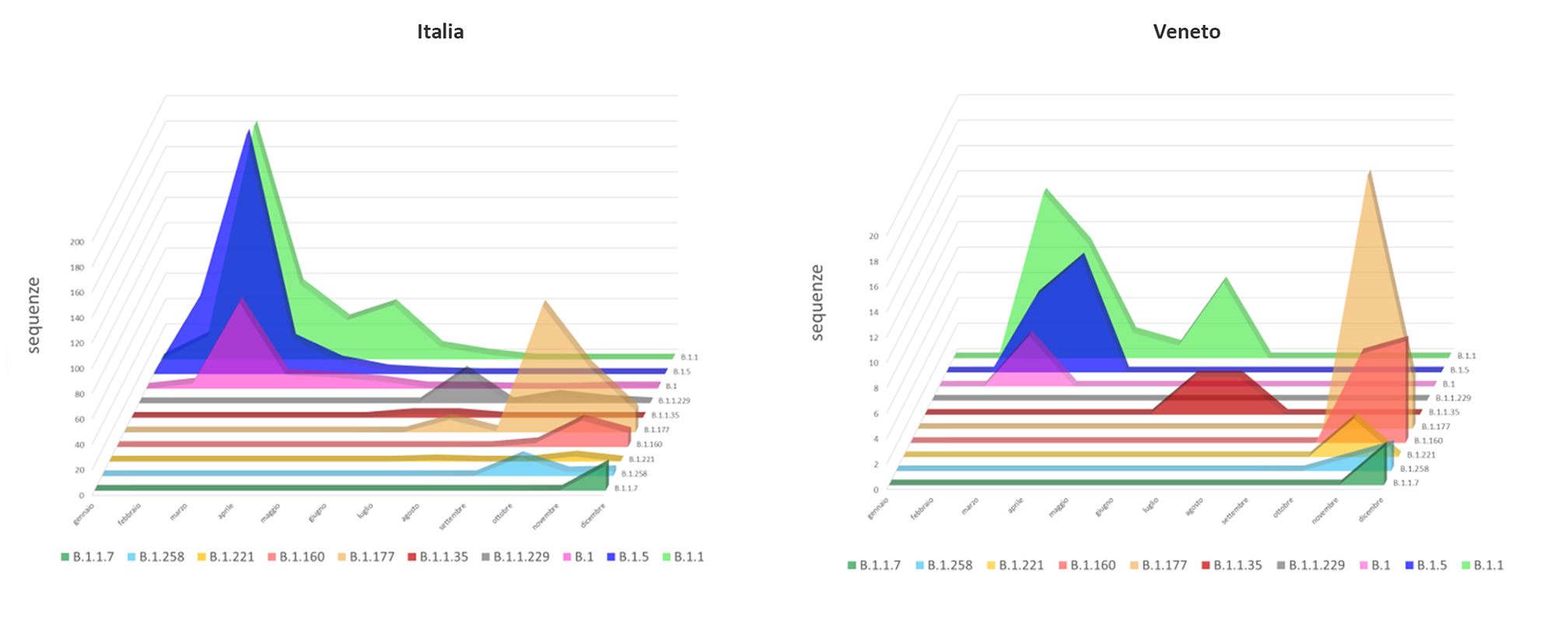
Figura 2. Distribuzione mensile dei principali lineage circolanti. A sinistra il dato relativo all’Italia mentre a destra quello relativo alla sola regione Veneto. Si può notare in entrambi i grafici che i genotipi B.1, B.1.5 e B.1.1 non sono più stati rilevati nella seconda metà dell’anno mentre sono invece diventati prevalenti i genotipi B.1.177 e B.1.160 (dati basati sulle sequenze italiane disponibili in GISAID in data 30/12/2020).
Referenze
- Bal A, Destras G, Gaymard A, Regue H, Semanas Q, d’Aubarde C, Billaud G, Laurent F, Gonzales C, Valette M, Lina B, Morfin F, Josset L. Screening of the H69 and V70 deletions in the SARS-CoV-2 spike protein with a RT-PCR diagnosis assay reveals low prevalence in Lyon, France. medRxiv 2020, 2020.11.10.20228528.
- Kemp, Steven A., Dami A. Collier, Rawlings Datir, Salma Gayed, Aminu Jahun, Myra Hosmillo, Isabella Atm Ferreira, et al. 2020. Neutralising Antibodies Drive Spike Mediated SARS-CoV-2 Evasion. medRxiv. https://www.medrxiv.org/content/10.1101/2020.12.05.20241927v1.full.
- Andrew Rambaut, Edward C. Holmes, Áine O’Toole, Verity Hill, John T. McCrone, Christopher Ruis, Louis du Plessis, and Oliver G. Pybus. 2020. A Dynamic Nomenclature Proposal for SARS-CoV-2 Lineages to Assist Genomic Epidemiology. Nature Microbiology 5 (11): 1403–7.
- Thomson EC, Rosen LE, Shepherd JG, Spreafico R. et al. 2020. The Circulating SARS-CoV-2 Spike Variant N439K Maintains Fitness While Evading Antibody-Mediated Immunity. bioRxiv. https://www.biorxiv.org/content/10.1101/2020.11.04.355842v1.abstract.
- Zhuoming Liu, Laura A. VanBlargan, Paul W. Rothlauf, Louis-Marie Bloyet, Rita E. Chen, Spencer Stumpf, Haiyan Zhao, John M. Errico, Elitza S. Theel, Ali H. Ellebedy, Daved H. Fremont, Michael S. Diamond, Sean P. J. Whelan. Landscape analysis of escape variants identifies SARS-CoV-2 spike mutations that attenuate monoclonal and serum antibody neutralization. bioRxiv 2020.11.06.372037; doi: https://doi.org/10.1101/2020.11.06.372037
- Francesco Ortuso, Daniele Mercatelli, Pietro Hiram Guzzi, Federico Manuel Giorgi. Structural Genetics of circulating variants affecting the SARS-CoV-2 Spike / human ACE2 complex. bioRxiv 2020.09.09.289074; doi: https://doi.org/10.1101/2020.09.09.289074
- Starr TN, Greaney AJ, Hilton SK, Ellis D, Crawford KHD, Dingens AS, Navarro MJ, Bowen JE, Tortorici MA, Walls AC, King NP, Veesler D, Bloom JD. Deep Mutational Scanning of SARS-CoV-2 Receptor Binding Domain Reveals Constraints on Folding and ACE2 Binding. Cell. 2020 Sep 3;182(5):1295-1310.e20. doi: 10.1016/j.cell.2020.08.012.
- Erik Volz, Verity Hill, John T. McCrone, Anna Price, David Jorgensen, Áine O’Toole, Joel Southgate, et al. 2020. Evaluating the Effects of SARS-CoV-2 Spike Mutation D614G on Transmissibility and Pathogenicity. Cell, November. https://doi.org/10.1016/j.cell.2020.11.020.





![«Emergenze sanitarie ai tempi di internet». Imparare dalla storia per affrontare le emergenze sanitarie [Libro]](https://www.izsvenezie.it/wp-content/uploads/2024/07/emergenze-sanitarie-tempi-internet-500x383.jpg)


